小児悪性リンパ腫
はじめに
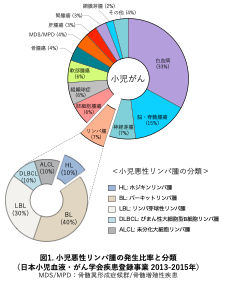
小児悪性リンパ腫は、ヒトの免疫細胞のうち「リンパ球」ががん化したことに起因する血液由来のがんです。小児がんの約7〜10%を占め、白血病、脳・脊髄腫瘍、神経芽腫に次ぐ4番目に多い疾患で(図1)、発生率は人口100,000人あたり0.6人といわれています。日本小児血液・がん学会による疾患登録事業の集計によると、年間約140名のお子さまが新規の悪性リンパ腫と診断されています。3〜11歳に多く、男子が女子の2倍多いです。
原発部位の約70%がリンパ節で、頚部・縦隔(じゅうかく)・腋窩(えきか)・腹部などに生じます。リンパ節以外の部位に発生することもあり、これを節外病変(せつがいびょうへん)といいます。節外病変には、眼窩(がんか)・鼻咽頭(びいんとう)・扁桃(へんとう)などの頭頸部の他に、胸膜(きょうまく)、肝臓、腎臓、骨、卵巣、精巣などが挙げられます。つまり、リンパ腫は体のあらゆる部分から発生し、その症状は多彩です。
小児悪性リンパ腫は、ホジキンリンパ腫(Hodgkin Lymphoma: HL)と非ホジキンリンパ腫(non-Hodgkin Lymphoma: NHL)に大別されます。本邦では小児悪性リンパ腫の約10%がHL、約90%がNHLであり、年間発生数はそれぞれ15〜30例、100〜140例とされ、造血器腫瘍(血液細胞に由来する腫瘍)の約2%、10%を占めます。日本では欧米と比べてHLが少ないのが特徴です。また、小児NHLは男児に好発し、15歳未満では70%以上が男児という報告もあります。
小児悪性リンパ腫の初発症状
リンパ腫はあらゆるリンパ節と節外から発生するため、発熱やリンパ節腫脹のみならず、長引く気道・腹部症状・疼痛(とうつう)など症状はさまざまです。リンパ腫の病型によっても、進行速度が異なったりと臨床症状の現れ方も多様です。特記すべきは、痛みのないリンパ節の腫れの他に、B症状と呼ばれる原因不明の発熱、寝汗および体重減少の3兆候はリンパ腫を疑う症状です。しかし、リンパ腫の患者さますべてにB症状を呈するわけではありません。例えば、HL患者さまのうち75%の方の初発症状が無痛性頚部リンパ節腫脹で、B症状を呈する方は40%とされています。以下に主な症状を分けて記載いたします。
B症状
診断から6ヶ月以内の以下の症状を指します。
- 原因不明の38℃以上の発熱
- 多量の寝汗
- 原因不明の10%以上の体重減少
表在リンパ節腫大
部位
全身のあらゆる部位から腫れてきます。鎖骨の上の部分でリンパ節が腫れている場合は病的なことが多いです。
サイズ
1cmを超えるリンパ節は病的です。悪性リンパ腫の場合は、2cm以上に腫大することが多いです。ただし、小児は一般的な感染症(ウイルス感染による上気道感染など)に罹患した時に反応性に腫大したり、生理的にリンパ節が触れる場合も多く、判断は難しいこともあります。
性状
典型的には①無痛性(触っても痛くない)、②弾性硬(テニスボールのようにやや硬い)、③可動制限あり(腫大したリンパ節はガチガチに固まっていて動かしづらい。生理的な腫大リンパ節は動かしやすい。)とされますが、細菌感染やウイルス感染が併発していると痛みを伴ったり、例外もあります。
気道症状
- 縦隔、胸腺、胸膜に発生したリンパ腫で認めます。具体的な症状は、咳、喘鳴(ゼイゼイ)、呼吸困難です。このような気道症状はある程度進行してから出現するため、症状を認めた時はすでに進行していることが多いとされます。
- 腫大した頚部リンパ節や縦隔リンパ節によって、空気の通り道である気管が圧迫されると、呼吸困難が出現し「上縦隔症候群」という危険な状態に陥ることがあります。このような状態では、気管の圧迫が強まるような姿勢や処置は絶対に避けるべきであり、慎重な診察が求められます。
- 胸膜病変が存在すると、胸膜炎といって、肺を包む膜に炎症が生じて、胸膜から滲出液が産生されることがあります(胸水)。胸痛や咳がみられます。胸水貯留が進行すると、吸気時の肺の膨張が妨げられ呼吸困難となって症状が現れます。
腹部症状
- 腹腔内には腸や肝臓、腎臓、脾臓など多数の臓器が入っています。どの臓器にもその周囲には多数のリンパ節が存在し、どのリンパ節にもリンパ腫が発生する可能性があります。
- 頻回な嘔吐、腹痛、腹部膨満が主な症状です。腸管が腫大したリンパ節で閉塞された場合は便秘になります。しかし、中には胃腸炎や便秘症と判断されることもあり、診断は困難なことも多いとされます。
- 腸重積症の合併:腸管リンパ節(特に回腸末端部)が腫大した時に合併することがあり、腹痛、嘔吐、血便をきたします。
中枢神経症状
脳や脳周囲の病変が生じた場合にみられ、嘔気・嘔吐・頭痛・脳神経麻痺(眼位異常や視野異常などの眼症状、聴力障害、顔面の左右差)などを呈します。
疼痛
これまで記してきた頭痛・胸痛・腹痛以外に、骨痛が挙げられます。骨原発のリンパ腫では腫瘍細胞浸潤による痛みが現れます。
その他
黄疸
肝周囲のリンパ節腫大できたすことがあります。
脊髄圧迫症状
腫瘍が脊髄周囲を覆う椎体や傍脊椎部を侵して生じます。障害された脊髄レベルに応じて、さまざまな麻痺症状が出現します。
上大静脈症候群
腫大した頚部や鎖骨上リンパ節が、上大静脈(頭、首、両腕の血液を心臓に返す血管)を圧迫することが原因で生じます。頭・首・腕の血液うっ滞が起こり、同部位の浮腫(むくみ)や呼吸困難、頻脈をきたします。
腫瘍崩壊症候群
リンパ腫のうち腫瘍細胞の増殖が極めて速い病型で多くみられます。高尿酸血症・高K血症・低Ca血症から腎障害(尿量低下)や不整脈などをきたし、非常に危険な状態です。
小児悪性リンパ腫の病理学的分類
病変部の腫瘍を一部採取し(生検)、顕微鏡で観察する検査を「病理学的検査」といいますが、これに基づいて診断し分類することを「病理学的分類」と呼びます。以下にNHLとHLの病理学的分類を示します。
ホジキンリンパ腫(HL)
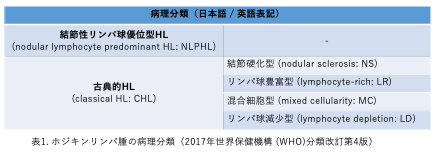
HLは特異細胞の細胞形態、免疫形質や遺伝子以上、臨床像の相違から、以下のように分類されます(表1)。特にHodgkin Reed-Sternberg (HRS)細胞やPop-corn細胞(またはlymphocytic and/or histiocytic cell (L & H細胞))などHLに特徴的な細胞を、細胞表面抗原を用いた免疫組織染色(CD30やCD15などの細胞膜に表出する抗原を特異的抗体を用いて蛍光染色します)を用いて同定し、結節性リンパ球優位型HLと古典的HLに大別します。前者ではCD30陰性Pop-corn細胞、後者ではCD30陽性HRS細胞の増生がそれぞれ認められます。古典的HLはその病理像に基づいてさらに4つに分類されます(結節性硬化型、リンパ球豊富型、混合細胞型、リンパ球減少型)。
非ホジキンリンパ腫(NHL)
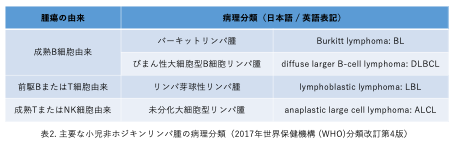
小児NHLは多様な病型がみられる成人と異なり、発症する病型が限られていることが特徴です。小児NHLの9割以上が以下の4病型で占められています(表2、図1)。この病型は腫瘍の由来細胞により分類され、細胞表面抗原を用いた免疫組織染色(CD3やCD19、CD20、CD30、CD56などの抗体が用いられます)などを用いて精査し診断されます。
小児悪性リンパ腫のうち、BLが約40%と最多で、次いでLBLが約30%と続きます。LBLの中ではT細胞性LBLがB細胞性LBLに比して多い傾向があり、その比率はT:B = 8:2程度とされます。また、T細胞性LBLは男児が女児に比較して2.5倍多いともいわれています。他に稀なNHL病型として、末梢性T細胞リンパ腫(peripheral T-cell lymphoma: PTCL)、濾胞性リンパ腫(follicular lymphoma: FL)、節外性NK/T細胞リンパ腫, 鼻型(Extranodal NK-/T-cell lymphoma, nasal type: ENKL)などがあります。
小児悪性リンパ腫の診断・検査
病理検査
小児悪性リンパ腫の診断は、病理検査が最も重要です。生検(手術や消化管内視鏡などにより主要組織の一部を採取すること)により採取された腫瘍組織を用いて、プレパラート標本を作製し顕微鏡で確認し、病理組織学的に診断します。
病理検査の中には、前述した「免疫組織染色法」という手法を用いて分子生物学的な検査も含まれ、詳細な精査が行われます。これは、細胞表面抗原といって腫瘍細胞の細胞膜上に表出されている特徴的なタンパク質(抗原)を、特異的な蛍光抗体を用いて反応させ、蛍光発色の有無をみるものです。例えば、特異的抗原として、B細胞ではCD10, CD19, CD20, CD79a、T細胞ではCD3, CD4, CD8、NK細胞ではCD16とCD56、HRS細胞ではCD15とCD30、Pop-corn細胞ではBCL-6などが挙げられます。
フローサイトメトリーによる免疫学的検査
上記の免疫組織染色法と同じような原理で、細胞表面抗原を検出する検査には「フローサイトメトリー」という方法もあります。生検で採取された腫瘍組織を細かくほぐした検体を、フローサイトメーターという特殊な機械に通して、腫瘍細胞の免疫学的特徴を精査し、診断につなげます。例えば、LBLでは、顕微鏡(組織学的)のみではT細胞性なのかB細胞性なのか区別がつきませんので、フローサイトメトリーを用いて細胞表面抗原パターンから両者を鑑別します。また成熟B細胞腫瘍の特徴として、表面免疫グロブリン(Sm-Igと表記します)、特にμ鎖の発現がみられるため、前駆B細胞由来のLBLとの鑑別に用いられます。
染色体検査や遺伝子検査
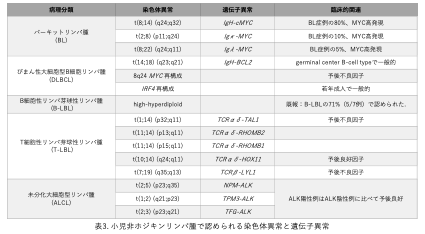
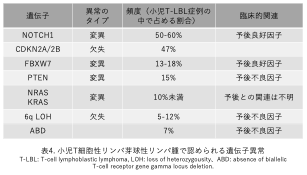
腫瘍組織検体は染色体検査や遺伝子検査にも用いられ、病型を確定します。病理分類されたそれぞれのリンパ腫には、特徴的な染色体異常や遺伝子異常が判明しており、確定診断に直結するとともに予後予測にも有用とされます(表3)。また近年、T細胞性リンパ芽球性リンパ腫 (T-LBL)の発症や進展に関与する遺伝子異常が見いだされ、予後との関連が報告されました(表4)。
このように生検で採取された腫瘍組織は、決定的かつ貴重な診断材料となるので、できる限り安全で侵襲の少ない方法で十分量の検体を採取することが非常に大切です。初回の病理検体こそが、正確な病理組織診断および分子生物学的診断に大きく寄与します。
画像検査
胸部・腹部レントゲン撮影を含めて、病変部を中心にCTやMRIを撮影します。また、全身検索目的に病変部以外の部位の画像検査も必須です。特に、T-LBLやDLBCLは縦隔腫瘤を有することが多く、胸水や上大静脈症候群をきたす可能性が高いため注意を要します。
HLではFDG-PET(陽電子放射線断層撮影:positron emission tomography, PET)と呼ばれる核医学検査が有用とされ、確立された方法として頻用されています。FDGとはfluorodeoxy glucoseという糖物質で、正常な細胞より糖分を多く消費して増殖する腫瘍細胞に強く取り込まれます。この作用を利用してFDGに核種をくっ付けて患者さまに経静脈的に投与し、一定時間に画像撮影しFDGの集積の程度を調べることで、腫瘍の局在を明らかにすることができます。FDG-PET検査は頭から足先まで全身をくまなく検索できるため、普及が急速に進んでいます。しかし一方で、FDGの取り込みが悪い腫瘍も存在します。このような腫瘍ではFDG-PETは有用ではありません。実際には、小児NHLにおけるFDG-PET検査による評価の経験は十分でなく、結果の解釈には慎重な姿勢が求められています。小児NHLでは、FDG-PET検査のみの結果に基づいた病期決定や治療効果判定は推奨されておりません。すでに普及している従来のGaシンチグラフィーは全身検索目的に施行される場合もあります。なお、MRIやPET検査は検査に時間がかかるので、幼少なお子さまには鎮静(静脈麻酔)が必要になる場合があります。
血液・尿検査
白血球減少、貧血、血小板減少がないかどうか、また肝腎機能や電解質バランスをチェックします。腫瘍崩壊症候群のモニタリングにも非常に大切な検査となります。可溶性インターロイキン2受容体(sIL-2R: soluble IL-2 receptor)という物質を血液検査で測定でき、時に病勢マーカーとして有用な場合があり、検査することもあります。
EBウイルス感染症検査
HLの約半数が、NHLの一部の病型が、EBウイルス感染症を病因として発症するとされています。特にHLでは、EBウイルス陽性例は陰性例に比べて予後不良です。このように悪性リンパ腫ではEBウイルス検査も行われます。検査方法は、血中のEBウイルスDNA定量(PCRという手法を用います)や抗体価の測定、さらに生検で得られた腫瘍組織標本を用いてEBウイルスを検出する免疫組織染色法にて行います。
髄液検査
中枢神経系である脳と脊髄は、髄膜(ずいまく)という膜で覆われ、その内側に髄液(ずいえき)と呼ばれる体液で満たされた髄腔(ずいくう)というスペースで守られています。この髄液中にリンパ腫の腫瘍細胞が浸潤してしまうことがあり、腰椎穿刺(ようついせんし)という検査手法で髄液を採取し、腫瘍細胞がいないか確認します。この腰椎穿刺は動くと危ないので、小児患者さまのほとんどは安全のために鎮静(静脈麻酔)して実施させていただいています。主にこの髄液検査と頭部CT/MRI検査をもって、中枢神経系浸潤の有無を評価します。
骨髄検査
腫瘍細胞の骨髄浸潤の有無を評価するために行います。うつ伏せになって寝ていただき、鎮静下(静脈麻酔)で腸骨を穿刺し骨髄血を採取して検査をいたします。LBLは骨髄浸潤をきたしやすく(白血病化しやすい)、骨髄浸潤例では急性リンパ性白血病(acute lymphoblastic leukemia: ALL)との鑑別が問題となります。腫瘍細胞が有核細胞の25%未満であればLBLの骨髄浸潤と判定し、25%以上となれば白血病化と判定します。
眼科・耳鼻咽喉科による精査
腫瘍細胞の浸潤の有無や治療の副作用などをチェックする目的で、眼底(目の奥)を観察したり、聴力検査をしたり、鼻や喉の診察をいたします。小児科医ではなく、眼科医や耳鼻咽喉科医に依頼して診ていただきます。
小児悪性リンパ腫の病期分類
小児NHLの病期診断にはSt. Jude staging system(Murphy分類)が汎用されています(表5)。

小児HLの病期診断では改訂Ann Arbor分類が広く用いられます(表6)。

これらに加えて、初発時の血中LDH値(血液検査で分かります)や中枢神経浸潤の有無によって治療強度を変更する戦略も行われています。
小児悪性リンパ腫の治療
Oncologic emergencyへの対応
まず、小児悪性リンパ腫の診断・治療開始時には、気道圧迫による気道狭窄、上大静脈症候群、脊髄圧迫、腫瘍崩壊症候群など緊急対応を要する病態が少なくありません。このような緊急的状態をoncologic emergencyといいます。確定診断までの期間や治療開始早期は、腫瘍量も多く病勢も強いことが多いため、これらの合併症が急速に進行する危険があります。したがって、疾患特異的な化学療法(抗腫瘍薬を用いた治療)に優先してoncologic emergencyに対する適切な対応がまず重要です。大量の輸液(点滴)をしたり、利尿薬(尿を出す薬)を投与したり、緊急的に放射線照射(X線などを体の外から当てること)や腫瘍摘出術(手術)を行ったり、患者さまの状態に合わせて様々な対応策が施されます。
疾患特異的な治療
小児悪性リンパ腫はいずれの進行病期であっても、化学療法で70〜90%の無イベント生存率、80〜90%の5年生存率が得られるほど治療は進歩しています。病型により治療プロトコールが異なりますので、治癒するには適切な診断、病期分類がとても重要となります。ここでいう「化学療法」とは抗腫瘍薬(抗がん剤ともいいます)を用いた治療を指し、ほとんどの場合、複数の抗腫瘍薬を組み合わせた多剤併用化学療法を施行します。
一方、どの病型においても再発・難治例に関する標準治療は確立しておらず、予後も厳しいのが現状で、急ピッチに新規薬剤の開発が世界各地で進められています。
成熟B細胞リンパ腫:バーキットリンパ腫(BL)とびまん性大細胞型B細胞リンパ腫(DLBCL)
小児の成熟B細胞リンパ腫の代表的な病型であるBLとDLBCLは、同じ化学療法レジメンで治療されます。以下のような抗腫瘍薬が用いられます。
- シクロフォスファミド(アルキル化剤)
- ドキソルビシン(アントラサイクリン系抗がん剤)
- ビンクリスチン(ビンカアルカイド系抗がん剤)
- プレドニゾロン(ステロイド)
- メトトレキセート(代謝拮抗薬)
- シタラビン(代謝拮抗薬)
上記のような多剤併用化学療法により「短期ブロック型治療」を行うことが標準的で、おおよそ6ヶ月の治療期間です。また、中枢神経浸潤予防目的にメトトレキセートやシタラビン、プレドニゾロンの髄腔内投与も行われます(“髄液検査“のところで記載した”腰椎穿刺”という方法で鎮静下で実施します)。この短期ブロック型治療により、全体として90%以上の無イベント生存率が達成されています。ちなみに放射線照射は現在推奨されている化学療法レジメンでは一般的に行われません。さらに最近では、抗CD20モノクローナル抗体リツキシマブ (Rituximab)という分子標的薬が進行例に対して導入され、治療成績の向上が期待されています。CD20はB細胞の表面に表出されているタンパクで、リツキシマブはCD20陽性のB細胞だけ認識し攻撃して破壊します。当院でも患者さまの状態(病型や病期)に応じて積極的に使用しています
リンパ芽球性リンパ腫(LBL)
小児LBLの治療は、小児急性リンパ性白血病(acute lymphoblastic leukemia: ALL)と同じ治療が奏功するため、ALLの治療プロトコールに準じて行われます。前駆B細胞性LBLと前駆T細胞性LBLは生物学的に近縁であり、全く同一のプロトコールが使用されることが多いです。基本的な治療骨格はプレドニン、ビンクリスチン、L-アスパラギナーゼの3剤を基本に、アントラサイクリン系およびアルキル化薬を加えたものです。主に使用される薬剤を以下に示します。
- プレドニゾロン(ステロイド)
- ビンクリスチン(ビンカアルカイド系抗がん剤)
- L-アスパラギナーゼ(酵素製剤)
- ドキソルビシン(アントラサイクリン系抗がん剤)
- メトトレキセート(代謝拮抗薬)
- シタラビン(代謝拮抗薬)
- シクロフォスファミド(アルキル化剤)
プレドニゾロン先行治療 → 寛解導入療法 → 強化療法 → 再寛解導入療法 → 維持療法という流れで治療が進んでいきます。BLやDLBCLと同様に中枢神経浸潤予防目的にメトトレキセートやシタラビンの髄腔内投与も行われます。そして、中枢神経浸潤のない患者さまには予防的頭蓋内放射線照射は一般的には行われません。中枢神経浸潤のある患者さまのみに全頭蓋照射が施行されます。腫瘤への放射線照射は行われませんが、縦隔や頸部腫瘤によって気道が圧迫されるなど生命の危険がみられる時は、緊急的に放射線照射を施行する場合があります。
治療期間は約2年と長期間ですが、後半の1年は「維持療法」といってメトトレキセートとメルカプトプリンという抗腫瘍薬の内服を中心とした治療となり、外来通院していただきながら治療することが主流です(この期間は一般的に通学も可能です)。本邦では、LBL全体として約80%の無イベント生存率が達成されています。
未分化大細胞型リンパ腫(ALCL)
ALCLに対する標準治療は前述のBL, DLBCLやLBLとは異なり、完全には定まっていないのが現状です。現時点では、小児ALCLに対する国際共同臨床試験(ALCL99試験)が最も大規模なものであったことから、このプロトコールが標準治療と考えられています。ALCL99試験ではBLと同様に約6ヶ月間の「短期ブロック型治療」で、以下の抗腫瘍薬を組み合わせたレジメンで施行されました。
- デキサメタゾン(ステロイド)
- シクロフォスファミド(アルキル化剤)
- メトトレキセート(代謝拮抗薬)
- ドキソルビシン(アントラサイクリン系抗がん剤)
- イホスファミド(アルキル薬)
- シタラビン(代謝拮抗薬)
- エトポシド(トポイソメラーぜ阻害薬)
2年無イベント生存率は74.1%、2年全生存率は92.5%で、他の主なリンパ腫病型に比べて予後が悪い結果でした。
現在、再発・難治例に対して効果が期待されている薬剤にビンブラスチンとALK阻害薬があります。ALK阻害薬については「小児悪性リンパ腫の検査・診断」の項で述べたとおり(表3)、ALCLには未分化リンパ腫リン酸化酵素 (anaplastic lymphoma kinase: ALK)融合遺伝子が認められる場合があり、このようなALK陽性の患者さまには第2世代ALK阻害薬のアレクチニブ (alectinib)が有効とされ、効果が証明されて承認されています。さらに、近年、微小管阻害薬結合抗CD30モノクローナル抗体ブレンツキシマブ ベドチン (brentuximab vedotin)も再発例に対して効果が報告されており、予後の改善につながることが期待されています。
ホジキンリンパ腫(HL)
小児HLに対する標準的な治療は、多剤併用化学療法と低線量病変部放射線照射 (low-dose involved-field radiation therapy: LD-IFR)の併用療法が確立されており、進行期においても80%以上の生存率が得られています。
ただ、これまでの治療の課題として、抗腫瘍薬(特にアルキル化薬、アントラサイクリン系薬剤)および放射線照射量依存性の性腺障害、二次がん、心・肺障害などの重篤な晩期合併症が挙げられました。したがって、小児例に対する治療選択においては、晩期毒性の軽減が重要な課題です。近年は合併症リスク軽減のため、放射線治療の省略や線量の軽減、抗腫瘍薬の減量などの工夫が行われています。HLの治療には以下の薬剤が使用されています。
- プレドニゾロン(ステロイド)
- ビンクリスチン(ビンカアルカロイド系)
- エトポシド(トポイソメラーゼ阻害薬)
- ドキソルビシン(アントラサイクリン系抗がん剤)
- メトトレキセート(代謝拮抗薬)
- ブレオマイシン(アントラサイクリン系抗がん剤)
早期例(病期I, IIかつ巨大腫瘤を有さない症例)では、化学療法2〜4コースと低線量放射線照射(15〜25Gy)の併用療法が行われ、無イベント生存率は90%以上と非常に予後は良好です。
一方、進行例(病期IIB-IV、あるいは巨大腫瘤を有する症例)では、化学療法4〜8コースと低線量放射線照射(20〜25Gy)の併用療法が行われ、無イベント生存率は80%以上です。
今後の動向としては、晩期合併症の二次がんの発生が問題となっているため、放射線照射を軽減する試みがされています。
再発・難治例に対する治療戦略としては、以下の新規薬剤の効果が証明されています。上述した微小管阻害薬結合抗CD30モノクローナル抗体のブレンツキシマブ ベドチン(brentuximab vedotin)は2019年にすでに小児再発難治HLに対して承認され、CD30陽性のHLに効果が期待されています。また、免疫チェックポイント阻害薬である抗ヒトPD-1モノクローナル抗体のニボルマブ (nivolumab)はまだ承認されていませんが、再発難治例に対する効果が報告されており、小児への適応拡大が望まれます。
参考文献
- 日本小児血液・がん学会[編]. 小児血液・腫瘍学 2015, 診断と治療社
- 日本小児血液・がん学会[編]. 小児白血病・リンパ腫ガイドライン 2016, 金原出版
- 日本血液学会[編]. 血液専門医テキスト 改訂第2版 2015, 南江堂
- 滝田 順子[編]. 小児科ベストプラクティス 小児白血病・リンパ腫 Strategy and Practice 2021, 中山書店
- Franklin Bunn and Jon C. Aster[編]. ハーバード大学テキスト 血液疾患の病態生理 2012, メディカルサイエンスインターナショナル
- Osumi T, Mori Tetsuya, Fujita N, et al. Relapsed/refractory pediatric B-cell non-Hodgkin lymphoma treated with rituximab combination therapy: A report from the Japanese Pediatric Leukemia/Lymphoma Study Group. Pediat Blood Cancer 2016; 63: 1794-1799
- Fukano R, Mori T, Sekimizu M, et al. Alectinib for relapsed or refractory anaplastic lymphoma kinase-positive anaplastic large cell lymphoma: An open-label phase II trial. Cancer Sci 2020; 111: 4540-4547
- Naqpal P, Akl MR, Ayoub NM, et al. Pediatric Hodgkin lymphoma- biomarkers, drugs, and clinical trials for translational science and medicine. Oncotarget 2016; 7(41): 67551-67573
- Horton TM, Drachtman R, Chen Lu, et al. A phase 2 study of Bortezomib in combination with Ifosfamide/Vinorelbine in paediatric patients and young adults with refractory/reccurent Hodgkin lymphoma: A Children’s Oncology Group (COG) study. Br J Haematol 2016; 170(1): 118-122
- Davis KL, Fox E, Merchant MS, et al. Nivolumab in children and young adults with relapsed or refractory solid tumors or lymphoma (ADVL1412): a multicentre, open-label, single-arm, phase 1-2 trial. Lancet Oncol 2020; 21: 541-550
- Bonn BR, Rohde M, Zimmermann M, et al. Incidence and prognostic relevance of genetic variations in T-cell lymphoblastic lymphoma in childhood and adolescence. Blood 2013; 121: 3153-3160
- 小児血液・腫瘍性疾患の診断と治療のトピックス. 小児科診療 2015; 78(12), 診断と治療社
- 小児血液疾患 よくわかる最新知見. 小児科 2014; 55(11), 金原出版
- 野村 憲一. 悪性リンパ腫:診断と治療の進歩 診断へのアプローチ 染色体・遺伝子検査. 日内会誌 2008; 97(7), 1561-1567